Nei pazienti con Alzheimer, donanemab riduce la progressione di malattia del 35%. Si arriva al 60% se usato molto precocemente
![]()
“E’ una rivoluzione”, cosi si è espressa Maria C. Carrillo, responsabile scientifica dell’Associazione Alzheimer, presentando i dati dello studio clinico TRAILBLAZER-ALZ 2 condotto su donanemab nella malattia di Alzheimer sintomatica precoce.
Donanemab ha rallentato in modo significativo il declino cognitivo e funzionale nei pazienti con malattia di Alzheimer sintomatica precoce positiva per l’amiloide, riducendo il rischio di progressione; quasi la metà dei partecipanti trattati con donanemab nello stadio iniziale della malattia non ha mostrato progressione clinica a 1 anno.
Ulteriori analisi di sottopopolazione hanno dimostrato che i partecipanti allo studio con malattia in fase più precoce hanno avuto un beneficio ancora maggiore, con un rallentamento del declino del 60% rispetto al placebo.
I dati completi della Fase 3 sono stati presentati oggi all’Alzheimer’s Association International Conference (AAIC) 2023, ad Amsterdam, Paesi Bassi, e sono stati pubblicati contemporaneamente su JAMA.
“Questi risultati dimostrano che diagnosticare e trattare le persone più precocemente nel corso della malattia di Alzheimer può portare a un beneficio clinico rilevante”, ha affermato Alessandro Padovani, Presidente eletto della Società Italiana di Neurologia e Direttore dell’Istituto di Neurologia Clinica presso il Dipartimento di Continuità di Cura e Fragilità, AOU Spedali Civili di Brescia. “Il ritardo nella progressione della malattia nel corso della sperimentazione è significativo e può dare alle persone più tempo per fare le cose che sono significative per loro. Le persone che vivono con la malattia di Alzheimer precoce e sintomatica continuano a lavorare, a godersi i viaggi, a condividere tempo di qualità con la famiglia: vogliono sentirsi se stessi, più a lungo. I risultati di questo studio rafforzano la necessità di diagnosticare e trattare la malattia prima di quanto si faccia oggi.”.
“ I dati positivi di TRAILBLAZER-ALZ 2 danno speranza alle persone con malattia di Alzheimer, le quali hanno urgente bisogno di nuove opzioni terapeutiche. Questo è il primo studio di fase III in cui una terapia capace di modificarela progressione della malattia replica i risultati clinici positivi osservati in uno studio precedente”, ha affermato Huzur Devletsah, Presidente e Direttore Generale di Lilly Italy Hub. “ Se approvato, riteniamo che donanemab possa fornire alle persone con malattia di Alzheimer benefici clinicamente significativi, nonché la possibilità di completare il loro ciclo di trattamento già 6 mesi dopo che la placca amiloide è stata eliminata. Nell’ambito di un ecosistema sanitario già complesso per quanto riguarda il morbo di Alzheimer, dobbiamo continuare a rimuovere qualsiasi barriera di accesso alla diagnosi e terapia mirate all’amiloide”.
Meccanismo di azione
Donanemab (LY3002813) è un anticorpo monoclonale IgG1 umanizzato mirato contro un epitopo all’N-terminale di uno specifico tipo di amiloide beta (Aβ) – piroglutammato Aβ – che si trova solo nelle placche amiloidi cerebrali associate alla malattia di Alzheimer (AD). Agisce inducendo la clearance mediata dalla microgliali delle placche Aβ esistenti, con l’intento di rallentare il progressivo declino della funzione cognitiva associato all’AD. Il farmaco è frutto della ricerca di Eli Lilly.
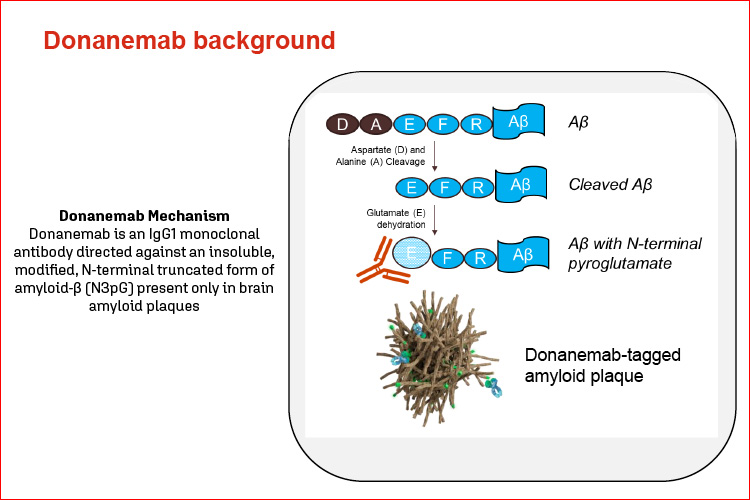
La maggior parte degli anticorpi anti-Aβ in fase di sviluppo terapeutico legano varie specie solubili o insolubili, ma hanno una bassa affinità con le placche amiloidi depositate. Il razionale alla base del donanemab è che per eliminare il carico di amiloide esistente dal cervello è necessario colpire la placca già depositata, piuttosto che limitarsi a prevenire la deposizione di nuove placche o la crescita di quelle esistenti. Alcuni precedenti anticorpi che legano la placca sono stati abbandonati perché causavano microemorragie nel cervello. L’anticorpo mE8 è stato segnalato per eliminare le placche nei topi senza causare microemorragie.
Lo studio di fase III
Lo studio ha arruolato 1736 pazienti, suddivisi tra donanemab e placebo. Coloro che durante lo studio diventavano negativi alla beta amiloide passavano al gruppo placebo.
I partecipanti sono stati randomizzati in un rapporto 1:1 a ricevere donanemab (n = 860) o placebo (n = 876) per via endovenosa ogni 4 settimane per 72 settimane. I partecipanti al gruppo donanemab sono passati a ricevere placebo in cieco se venivano soddisfatti i criteri di completamento della dose.
L’esito primario era la variazione del punteggio della scala integrata di valutazione della malattia di Alzheimer (iADRS) dal basale a 76 settimane (range, 0-144; punteggi più bassi indicano una maggiore compromissione). C’erano 24 esiti gated (primari, secondari ed esplorativi), compreso l’esito secondario della variazione della somma delle caselle del punteggio della Clinical Dementia Rating Scale (CDR-SB) (intervallo, 0-18; punteggi più alti indicano una maggiore compromissione).
Lo studio era stato originariamente concepito come uno studio di fase 2, ma è stato successivamente modificato in uno studio più ampio di fase 3 nel febbraio 2021, nel tentativo di confermare ed espandere i risultati del precedente studio TRAILBLAZER-ALZ.

Risultati dello studio
Nella popolazione a bassa/media tau, la variazione LSM dal basale nel punteggio iADRS a 76 settimane è stata di -6,02 (95% CI, da -7,01 a -5,03) nel gruppo donanemab e di -9,27 (95% CI, da -10,23 a -8,31) nel gruppo placebo (differenza, 3,25 [95% CI, 1,88-4,62]; P < .001), che rappresenta un rallentamento del 35,1% (95% CI, 19,90%-50,23%) della progressione della malattia (Figura 2, Tabella 2).
Nella popolazione combinata, la variazione LSM dal basale nel punteggio iADRS a 76 settimane è stata di -10,19 (95% CI, da -11,22 a -9,16) nel gruppo donanemab e di -13,11 (95% CI, da -14,10 a -12,13) nel gruppo placebo (differenza, 2,92 [95% CI, 1,51-4,33]; P < .001), che rappresenta un rallentamento del 22,3% (95% CI, 11,38%-33,15%) della progressione della malattia.
I risultati hanno dimostrato che donanemab ha rallentato in modo significativo, di oltre il 35%, il declino cognitivo e funzionale nelle persone con malattia di Alzheimer sintomatica precoce (decadimento cognitivo lieve o demenza lieve), confermando i dati topline rilasciati dall’azienda nel maggio 2023.
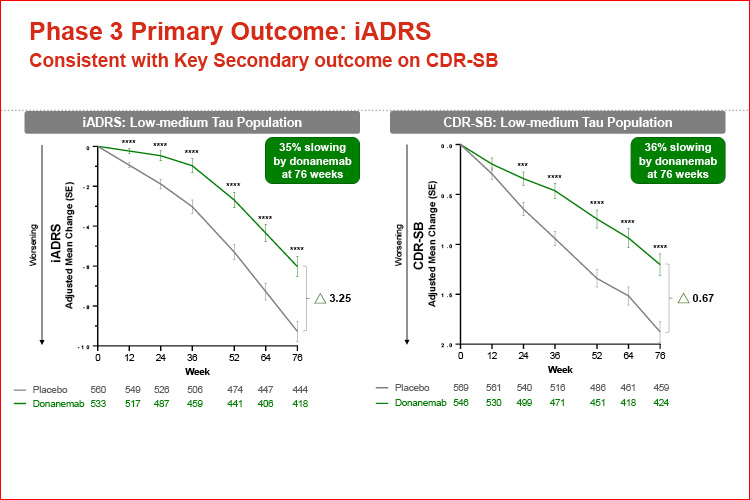
All’AAIC abbiamo appreso che l’effetto benefico del trattamento ha continuato ad aumentare rispetto al placebo nel corso dello studio, con le maggiori differenze rispetto al placebo osservate a 18 mesi.
I partecipanti allo studio nelle fasi più precoci della malattia hanno avuto maggiori benefici, con un rallentamento del 60% del declino rispetto al placebo. Benefici significativi sono stati riscontrati anche nei pazienti più avanzati.
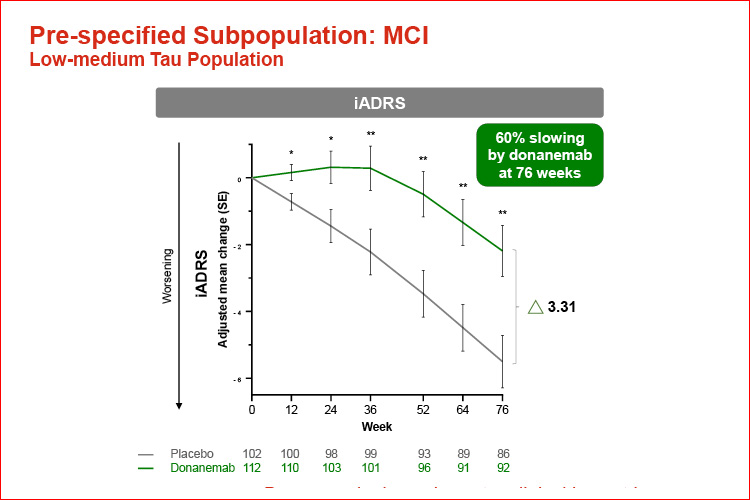
Il trattamento con donanemab ha determinato un beneficio clinicamente significativo (considerato come un rallentamento della progressione clinica >20%39-41) sulle scale iADRS e CDR-SB sia per la popolazione tau bassa/media che per quella combinata, indipendentemente dal modello statistico. Un ulteriore sostegno alla rilevanza clinica è dato dalla riduzione del rischio di progressione della malattia del 38,6% misurata sul punteggio CDR-G e dai 4,4-7,5 mesi risparmiati nell’arco dei 18 mesi di studio (popolazione tau medio-bassa).
Inoltre, si stima che il 47% dei partecipanti che hanno ricevuto donanemab non abbia subito cambiamenti nella CDR-SB a 1 anno (nessuna progressione della malattia), rispetto al 29% dei partecipanti che hanno ricevuto placebo.
“Con questo quadro più completo, ci sono ulteriori e convincenti prove scientifiche che la rimozione completa della beta amiloide dal cervello è associata a un significativo rallentamento della progressione della malattia nelle persone affette da Alzheimer precoce”, ha dichiarato Carrillo.
“I risultati dimostrano che l’inizio del trattamento il più precocemente possibile consente di ottenere un effetto benefico maggiore, ma anche che esiste un potenziale di rallentamento della progressione della malattia anche quando il trattamento viene iniziato più tardi nel corso della progressione della malattia”, ha detto Carrillo. “Questi benefici sono reali e significativi e danno alle persone più tempo per partecipare alla vita quotidiana, rimanere indipendenti e prendere decisioni future in materia di assistenza sanitaria”.
I partecipanti a TRAILBLAZER-ALZ 2 sono stati valutati nell’arco di 18 mesi utilizzando scale che misurano sia la cognizione che la funzionalità. Un’analisi prespecificata dei partecipanti con tau medio-bassa in base allo stadio clinico ha mostrato un maggiore beneficio di donanemab in coloro che si trovavano nelle fasi più precoci della malattia.
Sicurezza del farmaco
Come altri trattamenti anti-amiloide, anche questo trattamento ha effetti collaterali. Secondo l’azienda, il livello e la gravità delle anomalie di immagine legate all’amiloide, note anche come ARIA, erano coerenti con lo studio di fase 2 di TRAILBLAZER-ALZ. Le anomalie dell’imaging correlate all’amiloide (ARIA) consistono principalmente in edema cerebrale e emorragie.
L’ARIA è solitamente asintomatico, ma può essere grave. Questo rischio può essere gestito con un’attenta osservazione e monitoraggio e, se necessario, con la sospensione del trattamento. Spesso il trattamento può essere reintrodotto. I pazienti che vivono con una malattia mortale e le loro famiglie dovrebbero sempre parlare con i loro medici per sviluppare un piano di trattamento adatto a loro, valutando anche i benefici e i rischi delle terapie approvate.
Quando si verificano anomalie di imaging legate all’amiloide, sono per lo più asintomatiche e si risolvono in circa 10 settimane.Quando si manifestano, i sintomi sono generalmente lievi, consistenti in un mal di testa o in un aumento della confusione, ma possono essere più gravi, come le convulsioni.In alcuni casi, questi eventi possono essere pericolosi per la vita e provocare o portare alla morte.
Per l’1,6% dei partecipanti al gruppo di trattamento con donanemab, le anomalie di imaging correlate all’amiloide hanno portato a esiti gravi, come l’ospedalizzazione, e hanno richiesto cure di supporto e/o l’uso di corticosteroidi. È inoltre importante notare che 3 decessi in TRAILBLAZER-ALZ 2 si sono verificati in seguito a gravi anomalie di imaging correlate all’amiloide.
Un’ulteriore valutazione dei rischi associati alle anomalie di imaging gravi e pericolose per la vita legate all’amiloide sarà importante per identificare gli approcci migliori per gestire i rischi e massimizzare i benefici, oltre al trattamento precoce della malattia quando è presente una minore patologia amiloidea e, teoricamente, quando il rischio di anomalie di imaging legate all’amiloide è minore.
Passi successivi
L’azienda ha comunicato pubblicamente di aver completato la presentazione alla Food and Drug Administration (FDA) statunitense per l’approvazione tradizionale, con un’azione regolatoria prevista entro la fine dell’anno, e che sono in corso le presentazioni ad altre autorità regolatorie mondiali.
I test clinici su donanemab differiscono da quelli condotti sui due trattamenti anti-amiloide per l’Alzheimer approvati dalla FDA, in quanto i partecipanti allo studio vengono esclusi dal trattamento una volta raggiunto un livello predeterminato di eliminazione dell’amiloide dal cervello.
Una volta scesi al di sotto di una certa soglia, i pazienti sono stati rimossi dal trattamento e aggiunti al gruppo placebo. La metà (52%) dei partecipanti allo studio che hanno ricevuto il farmaco ha terminato il trattamento in meno di 12 mesi; il 72% lo ha completato entro 18 mesi.Si tratta di un risultato importante per i pazienti, le famiglie, i prescrittori e i finanziatori, perché i pazienti potrebbero non aver bisogno di ricevere questo trattamento in modo continuativo per il resto della loro vita.