Fibrosi polmonare idiopatica: bexotegrast al dosaggio maggiore sperimentato (320 mg) il raggiungimento dell’endpoint primario e degli endpoint secondari
![]()
Con un comunicato stampa, Pliant Therapeutics, azienda biotecnologica focalizzata sulla scoperta e lo sviluppo di nuove terapie per il trattamento della fibrosi, ha reso noto che bexotegrast, inibitore dell’integrina ανβ6, ha soddisfatto, al dosaggio maggiore sperimentato (320 mg) il raggiungimento dell’endpoint primario e degli endpoint secondari del trial di Fase 2a INTEGRIS-IPF sull’impiego di questo farmaco nel trattamento della fibrosi polmonare idiopatica (IPF).
I risultati sono molto promettenti e suffragano l’esistenza di un effetto antifibrotico dose-dipendente di questo farmaco, consistente con il suo meccanismo d’azione e i risultati pre-clinici ottenuti.
Informazioni su bexotegrast
Bexotegrast è un inibitore dell’integrina ανβ6. Bloccando questa integrina, il farmaco blocca a sua volta l’attivazione di TGF-β, un mediatore centrale della fibrosi polmonare, prevenendo in tal modo la formazione di tessuto fibrotico.
Bexotegrast ha ottenuto sia la designazione “Fast Track” che quella di “Orphan Drug” da parte della Fda statunitense relativamente all’IPF, e quella di “Orphan Drug” da parte di Ema per la stessa condizione clinica.
Lo studio INTEGRIS-IPF
Disegno dello studio
INTEGRIS-IPF è uno studio di Fase 2a, randomizzato, in doppio cieco, controllato con placebo, che ha valutato la sicurezza, la tollerabilità e la farmacocinetica di bexotegrast somministrato a dosi diverse in pazienti con IPF.
Lo studio ha reclutato 119 pazienti randomizzati a trattamento attivo (ai dosaggi di 40, 80, 160 o 320 mg) o a placebo una volta al giorno per 12 settimane, secondo uno schema di randomizzazione 3:1 (trattamento attivo:placebo) e stratificati in base alla terapia standard.
Di questi 119 pazienti, 21 erano stati randomizzati a trattamento con bexotegrast al dosaggio maggiore. In modo paragonabile ai pazienti trattati con il farmaco a dosaggi inferiori, quasi l’80% di tutti i pazienti reclutati era sottoposto a terapia standard of care (nintedanib e pirfenidone).
L’endpoint primario era rappresentato dalla valutazione della sicurezza e della tollerabilità di bexotegrast, mentre l’endpoint secondario era rappresentato dalla valutazione della farmacocinetica in un intervallo di dosi.
Il protocollo di studio, inoltre, prevedeva anche la valutazione di alcuni endpoint esplorativi che hanno misurato la variazione della Capacità Vitale Forzata (FVC), il punteggio della Fibrosi Polmonare Quantitativa (QLF) basato sulla Tac a risoluzione elevata (HRCT) e alcuni biomarcatori selezionati.
Risultati principali
– Endpoint primario e secondario
Il trattamento con bexotegrast a 320 mg è risultato ben tollerato nel corso delle 12 settimane di trattamento, in assenza di eventi avversi severi o seri non legati al farmaco. Inoltre, il suo impiego è risultato associato a incrementi delle concentrazioni plasmatiche proporzionali alla dose utilizzata.
– Effetti su FVC, QLF e su alcuni marker pro-fibrotici vs Placebo a 12 settimane
Considerando gli endpoint di efficacia esplorativi, è stato documentata l’esistenza di un forte effetto dose-dipendente del trattamento nel gruppo trattato con bexotegrast 320 mg, in presenza e in assenza di terapia standard.
Il trattamento con bexotegrast 320 mg è stato accompagnato da un incremento medio della FVC di +29,5 mL rispetto al basale a 12 settimane, rispetto ad un calo di 110,7 mL nel gruppo placebo, con un aumento netto di 140 mL rispetto al placebo.
Gli incrementi medi di FVC rispetto al placebo hanno raggiunto la significatività statistica in tutti i timepoint considerati dello studio (fig.1).
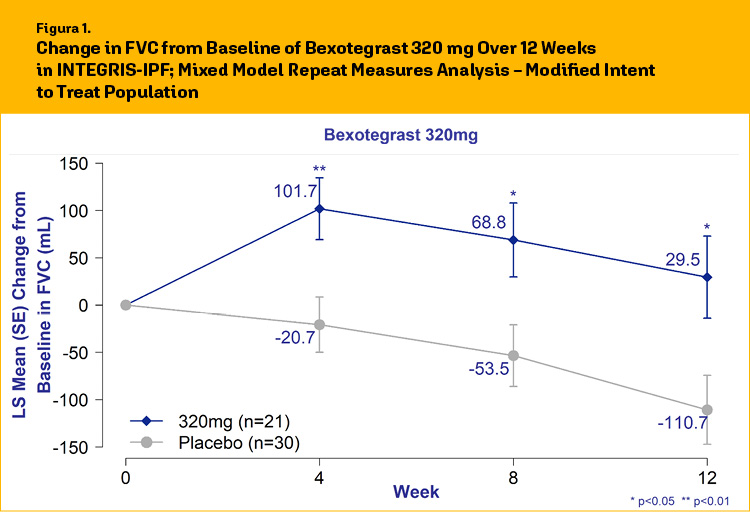
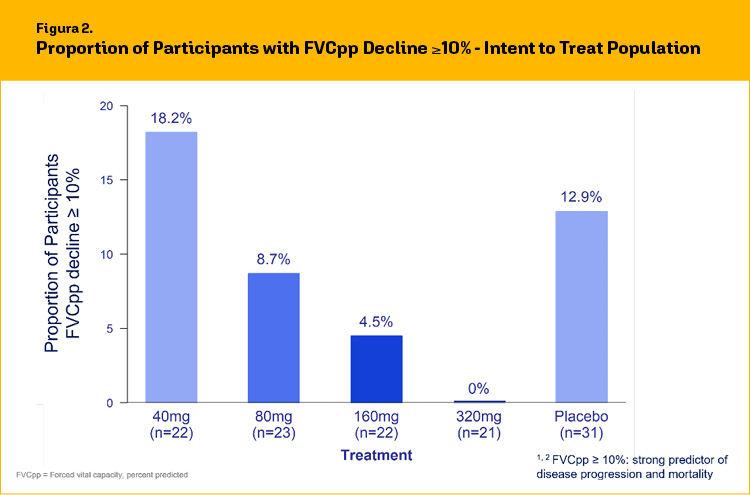
In letteratura è noto che un declino ≥10% della percentuale predetta di FVC (FVCpp) a 12 settimane si associa ad un incremento della mortalità nei pazienti nel corso di un biennio.
Ciò detto, nessun paziente trattato con bexotegrast 320 mg ha sperimentato un declino ≥10% di questo parametro di funzione polmonare (fig.2).
…
Passando al punteggio QLF (il cui incremento si associa al peggioramento della fibrosi polmonare), è emerso che la variazione percentuale media di questo punteggio a 12 settimane era dello 0,2% nel gruppo trattato con bexotegrast 320 mg rispetto all’1,46% nel gruppo placebo.
Concludendo con l’analisi di alcuni marcatori pro-fibrotici, il trattamento con bexotegrast ha ridotto significativamente a 4 e a 12 settimane, rispetto a placebo: 1) i livelli di PRO-C3 – un biomarcatore sierico della sintesi di collagene di tipo III presente a livelli elevati nei pazienti con IPF e associato a malattia progressiva); 2) i livelli di integrina beta-6 che, se presente a livelli elevati, è associata a progressione di interstiziopatia polmonare – definita da mortalità, trapianto o riduzione relativa ≥ 10% della FVC (mL) a 12 mesi.
Riassumendo
In conclusione, i risultati ad interim (12 settimane) dello studio INTEGRIS-IPF hanno dimostrato la buona tollerabilità di bexotegrast 320 mg dopo 12 settimane di trattamento, in assenza di problemi di safety, oltre a migliorare in modo significativo la FVC a 4, 8 e 12 settimane di trattamento, superando i risultati ottenuti con i dosaggi più basso. Inoltre, nessun paziente trattati con bexotegrast ha sperimentato la progressione di malattia, definita da un declino di FVCpp pari o superiore al 10%.
Sono attesi per il secondo trimestre dell’anno i risultati dei pazienti del trial trattati con il farmaco al dosaggio maggiore per almeno 24 settimane.
Soddisfazione per i primi risultati del trial è stata espressa dai vertici dell’Azienda che sperano, con la continuazione del programma si sviluppo clinico di bexotegrast nel trattamento dell’IPF e le attese conferme, di rispondere al bisogno ancora insoddisfatto di avere a disposizione nuove opzioni terapeutiche in grado non solo di aggredire la sintomatologia ma di modificare la progressione di questa malattia.