I primi pazienti con ittiosi congenita sono stati arruolati nella sperimentazione di fase III ASCEND avviata per l’isotretinoina topica
I primi pazienti con ittiosi congenita sono stati arruolati nella sperimentazione di fase III ASCEND avviata per l’isotretinoina topica, secondo quanto comunicato dalla compagnia Timber Pharmaceuticals che sta sviluppando il prodotto.
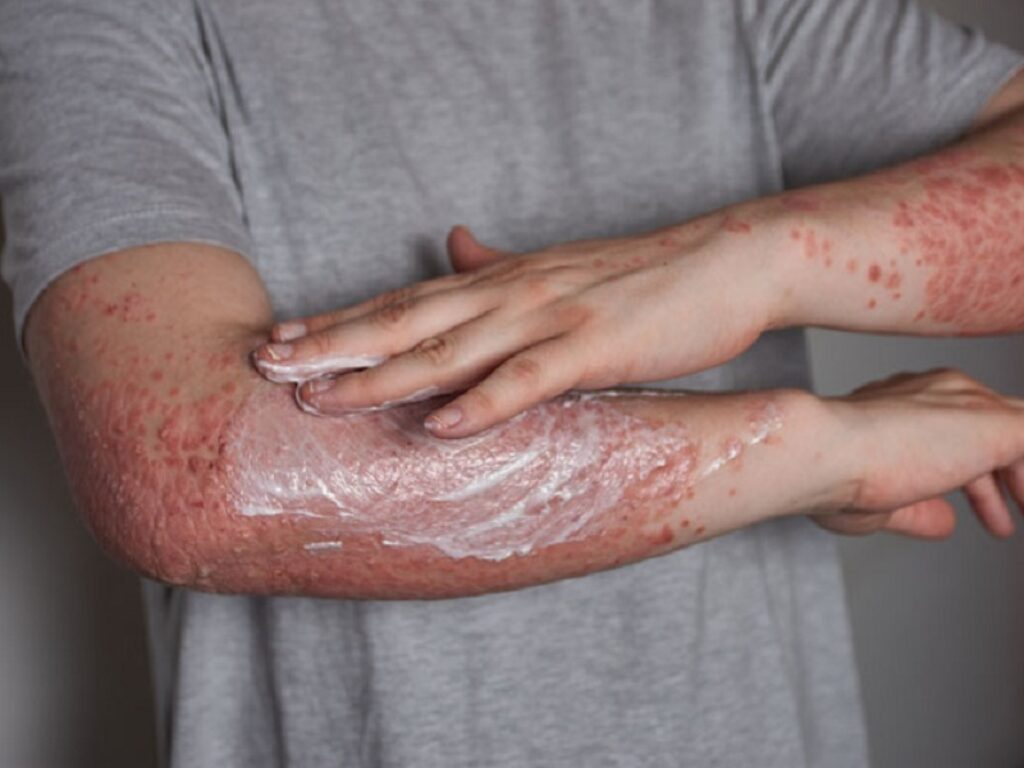
Le ittiosi sono un gruppo di malattie genetiche caratterizzate da una forte tendenza alla desquamazione cutanea. Il termine ittiosi fu utilizzato con lo scopo di indicare l’aspetto squamoso con cui si presenta la cute dei pazienti affetti. Queste patologie sono infatti caratterizzate da un difetto della corneificazione, ossia del processo di formazione e distacco delle cellule dello strato corneo della pelle e a si associano a disturbi anche extracutanei. Anche se la maggior parte dei casi di ittiosi sono ereditari, alcuni tipi si sviluppano in associazione a sindromi o malattie genetiche, come il linfoma di Hodgkin.
Le persone che vivono con l’ittiosi possono avere una gamma limitata di movimenti, prurito cronico, incapacità a sudare normalmente, alto rischio di infezioni secondarie e problemi di vista o udito. La malattia colpisce circa 80mila persone negli Stati Uniti e oltre 1,5 milioni nel mondo.
Non esistono terapie approvate per la malattia, ma la cura quotidiana della pelle di solito mantiene i sintomi a un livello lieve e gestibile nelle forme leggere. Il trattamento locale consiste nell’idratare e ammorbidire la pelle per evitare che diventi troppo secca e rigida, e nel limitare l’accrescimento delle squame e l’ispessimento della cute tramite trattamenti cheratolitici. Esistono anche terapie sistemiche che possono migliorare le condizioni delle persone con disturbi gravi, ma sono ancora in fase di sperimentazione e devono essere utilizzate sotto controllo medico.
Una prima potenziale terapia per la malattia
Il farmaco topico sperimentale allo 0,05%, per ora chiamato TMB-001, è stato formulato utilizzando il sistema di somministrazione brevettato IPEG (che consente di ottimizzare la consegna del principio attivo agli strati cutanei patologici riducendo al minimo l’assorbimento sistemico e rimuovendo gli eccipienti irritanti) e ha ottenuto le designazioni di farmaco orfano, Fast Track e Breakthrough Therapy dalla Fda, in virtù del sostanziale miglioramento rispetto alla terapia disponibile dimostrato dalle evidenze cliniche preliminari.
Nello studio CONTROL di fase IIb, il trattamento con TMB-001 ha dimostrato una riduzione clinicamente significativa della gravità dell’ittiosi congenita, abbinata a un profilo di sicurezza favorevole. Una sottoanalisi dello studio presentata al congresso dell’American Academy of Dermatology ha mostrato che il trattamento ha avuto successo indipendentemente dal sottotipo di ittiosi.
Secondo quanto riferito dall’azienda, molti dermatologi possono avere familiarità con l’isotretinoina orale e la sua efficacia come trattamento per l’ittiosi congenita, ma sono anche consapevoli della sua tossicità sistemica. La nuova formulazione topica ha le potenzialità per dare sollievo ai pazienti riducendo al minimo l’assorbimento sistemico e gli effetti collaterali osservati con la somministrazione, oltre alla possibilità di essere utilizzata in modo cronico e su aree più ampie del corpo.
Al via lo studio registrativo
Lo studio registrativo di fase III ASCEND, randomizzato, in parallelo, in doppio cieco e controllato con veicolo valuterà l’efficacia, la farmacocinetica e la sicurezza di TMB-001 0,05% e prevede di arruolare 142 pazienti dai 6 anni di età in avanti con ittiosi congenita, incluse la forma lamellare autosomica recessiva (ARCI-LI) o l’ittiosi recessiva legata al cromosoma X (XRI, X-linked recessive ichthyosi).
Per lo studio verranno forniti test genetici per i pazienti che non hanno una conferma genetica del sottotipo di malattia da cui sono affetti. I partecipanti saranno randomizzati in rapporto 2:1 a ricevere TMB-001 o il solo veicolo come controllo per 12 settimane. In seguito i soggetti idonei in entrambi i bracci varranno nuovamente randomizzati al trattamento con TMB-001 una volta al giorno o due volte al giorno per ulteriori 12 settimane, in modo da fornire informazioni sul trattamento prolungato.