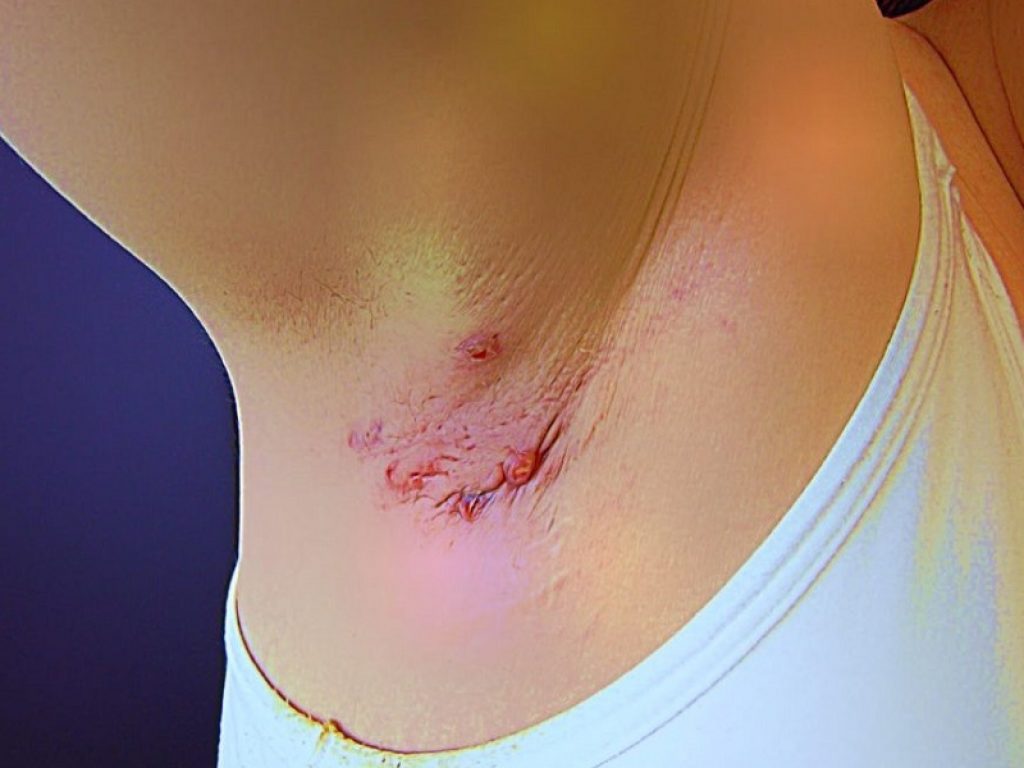
Le nuove potenziali opzioni terapeutiche per l’idrosadenite suppurativa sono in grado di migliorare i segni e sintomi della malattia tra il 50 e il 100%
Al congresso 2023 dell’American Academy of Dermatology (AAD) diverse relazioni hanno mostrato come le nuove potenziali opzioni terapeutiche per l’idrosadenite suppurativa sono in grado di migliorare i segni e sintomi della malattia tra il 50 e il 100%, risultati mai raggiunti in precedenza.
Izokibep, un nuovo inibitore dell’interleuchina (IL)-17A, ha portato a un miglioramento della malattia di almeno il 50% rispetto al basale (Hidradenitis Suppurative Clinical Response, HiSCR 50) dopo 12 settimane in 21 pazienti su 30, inclusa una risposta del 100% definita “senza precedenti” in un terzo dei soggetti. L’anticorpo monoclonale multitargeting eltrekibart ha consentito a due terzi di pazienti di ottenere una risposta HiSCR 50 in un piccolo studio controllato con placebo. Il follow-up a lungo termine in due studi randomizzati con il doppio inibitole dell’interleuchina (IL)-17A e 17F bimekizumab ha mostrato che i tassi di risposta hanno continuato ad aumentare fino a 1 anno e che i pazienti che sono passati dal placebo al farmaco attivo hanno ottenuto risultati positivi quanto quelli randomizzati a bimekizumab fin dall’inizio.
Izokibep
La struttura di izokibep (compagnia sviluppatrice Affibody) offre diversi potenziali vantaggi rispetto ad altre terapie per l’idrosadenite suppurativa, tra cui una maggiore potenza, una migliore penetrazione nei tessuti e un’emivita plasmatica estesa, insieme a un profilo di sicurezza ben tollerato, ha affermato il relatore Kim Papp, della Probity Medical Research in Waterloo, Ontario, Canada. «Abbiamo ottenuto risposte senza precedenti senza ulteriori segnali di sicurezza e le evidenze convincenti ne sostengono l’avanzamento nello sviluppo di fase III».
Il design molecolare di izokibep affronta una limitazione chiave di altre terapie utilizzate per trattare la malattia. Per ragioni ancora non del tutto chiare, nell’idrosadenite l’esposizione ai farmaci è inferiore rispetto ad altri tipi di condizioni infiammatorie. Nell’approvazione del 2015 di adalimumab per l’idrosadenite, la Fda ha sottolineato la minore concentrazione tissutale osservata in questi pazienti rispetto a quelli con psoriasi, e uno studio iniziale con bimekizumab ha rilevato che i livelli di farmaco circolanti erano inferiori alle attese.
A differenza di altri agenti anti-IL-17A, izokibep si lega contemporaneamente a entrambe le subunità proteiche della citochina, determinando una maggiore affinità e potenza. La piccola dimensione, 10 volte inferiore rispetto a un tipico anticorpo monoclonale, consente una maggiore concentrazione tissutale, e il legame con il dominio che lega l’albumina si traduce in un’emivita più lunga, ha riferito Papp.
La sicurezza e l’efficacia di izokibep sono state valutate in uno studio in aperto di fase IIb, il cui obiettivo era stabilire se il farmaco avesse caratteristiche cliniche tali da rendere plausibile un’ulteriore valutazione in uno trial di fase III. Ha coinvolto 30 pazienti con un’età media di 38 anni (quasi il 50% di colore e per il 70% donne) che presentavano una conta media di ascessi/noduli infiammatori di 7,0 e che per due terzi avevano una gravità di idrosadenite di stadio II di Hurley (presenza di uno o più ascessi ricorrenti con cicatrizzazione e formazione di tragitti fistolosi).
L’analisi ha mostrato un tasso di risposta HiSCR 50 del 71% a 12 settimane ma, ancora più rilevante, il 57% dei pazienti ha avuto risposte HiSCR 75, il 38% ha soddisfatto i criteri di risposta HiSCR 90 e il 33% ha avuto una clearance completa (HiSCR 100). Una risposta HiSCR 50 è abbastanza standard per gli studi clinici sull’idrosadenite, pertanto gli alti tassi di risposta HiSCR 75, 90 e 100 sono particolarmente significativi, dal momento che i pazienti con un elevato carico di malattia possono ancora avere una malattia residua sostanziale con una risposta HiSCR 50, ha fatto presente Papp.
L’evento avverso emergente dal trattamento (TEAE) più comune è stata la reazione al sito di iniezione (40%). Cinque pazienti presentavano prurito al sito di iniezione, quattro eritema e tre gonfiore al sito di iniezione.
Eltrekibart
Si tratta di un anticorpo monoclonale septa-specifico per i recettori delle chemochine CXCR1 e CXCR2, vale a dire che lega tutti e sette i ligandi dei due target, ha spiegato Seth Forman della ForCare Clinical Research di Tampa, in Florida. CXCR1 e 2 sono coinvolti nella migrazione dei neutrofili verso i siti di infiammazione, un processo chiave nella patogenesi della malattia cutanea.
Al congresso sono stati riportati i risultati di uno studio di fase II controllato con placebo su pazienti con malattia da moderata a grave (durata di almeno 6 mesi, almeno due distinte regioni anatomiche coinvolte con almeno una in stadio II di Hurley II e un conteggio di ascessi totali/noduli infiammatori di almeno 4,0). I partecipanti sono stati randomizzati in rapporto 2:1 a ricevere eltrekibart (compagnia sviluppatrice Eli Lilly) o placebo e l’endpoint primario era la percentuale di pazienti che raggiungeva una risposta HiSCR 50 alla settimana 16. Tutti hanno ricevuto la terapia di mantenimento con eltrekibart durante il follow-up fino a 36 settimane.
Sono state effettuate due analisi comparative. Un’analisi ha confrontato direttamente i risultati tra i bracci eltrekibart e placebo, mentre una seconda analisi prespecificata ha integrato i dati di confronto tra eltrekibart e placebo con i dati storici degli studi pubblicati.
L’analisi dei dati di risposta della settimana 16 ha mostrato che il 65,6% del gruppo eltrekibart ha ottenuto risposte HiSCR 50 rispetto al 41,4% del gruppo placebo e rispetto al 32,3% dei risultati del placebo aumentati. Forman ha affermato che le loro analisi includevano una probabilità a posteriori bayesiana del 61,9% di una differenza ≥30% a favore di eltrekibart e dei risultati aumentati del placebo.
La conta media di ascessi/noduli è diminuita di 6,8 con il trattamento attivo ma non è cambiata con il placebo. Durante la fase di mantenimento, il tasso di risposta HiSCR 50 a 36 settimane nel gruppo eltrekibart è aumentato all’81,9%.
I TEAE erano generalmente di gravità lieve o moderata. Un paziente nel gruppo eltrekibart ha interrotto a causa di eventi avversi durante il trattamento randomizzato e uno durante la fase di mantenimento. I più comuni sono stati infezione (incluso Covid-19), costipazione, diarrea, disturbi della pelle e disturbi muscoloscheletrici/artralgia. Forman ha sottolineato l’assenza di diverse tipologie di effetti collaterali, come eventi tromboembolici, infezione da herpes simplex e riduzione delll’emoglobina.
«La neutralizzazione specifica di sette distinti ligandi CXCR1 e CXCR2 rappresenta una promettente strategia terapeutica per l’idrosadenite e potenzialmente per altri disturbi con predominanza di neutrofili» ha concluso.
Bimekizumab
Come riportato in un articolo precedente, due studi randomizzati di fase III, BE HEARD I e BE HEARD II su un totale di 1.014 pazienti con idrosadenite moderata/grave, hanno mostrato tassi di risposta HiSCR 50 dal 45% al 54% alla settimana 16 in pazienti randomizzati a ricevere bimekizumab (compagnia sviluppatrice UCB) ogni 2 o 4 settimane. I partecipanti assegnati a bimekizumab hanno ricevuto un trattamento di mantenimento per 48 settimane mentre quelli nei gruppi placebo sono passati a bimekizumab dopo la settimana 16.
In entrambi gli studi, i soggetti che hanno ricevuto antibiotici di salvataggio o che hanno interrotto il trattamento sono stati considerati non responder. L’analisi dei dati con imputazioni multiple per la mancata risposta (mNRI) ha mostrato tassi di risposta HiSCR 50 a 48 settimane dal 53% al 61% con bimekizumab in BE HEARD I e dal 61% al 64% in BE HEARD II. I tassi corrispondenti per i pazienti che sono passati dal placebo al trattamento attivo a 16 settimane sono stati del 45% e del 68%, ha riferito la relatrice Alexa Kimball del Beth Israel Deaconess Medical Center di Boston.
I tassi di risposta HiSCR 50 con bimekizumab a 48 settimane variavano dal 77% all’80% in BE HEARD I e dal 76% all’82% in BE HEARD II. I tassi per i gruppi placebo switchati a bimekizumab sono stati rispettivamente del 66% e del 74% in BE HEARD I e II.
Le analisi mNRI sulla risposta HiSCR 75 hanno mostrato tassi a 48 settimane con bimekizumab che variavano dal 41% al 47% in BE HEARD I e dal 47% al 54% in BE HEARD II. I tassi corrispondenti per i gruppi placebo passati all’attivo erano del 40% e del 60%. Con le analisi dei casi osservati i tassi a 48 settimane con bimekizumab variavano rispettivamente dal 56% al 64% e dal 58% al 71% in BE HEARD I e II. I tassi di HiSCR 75 per i gruppi placebo passati a bimekizumab erano del 57% e del 67%.
Il farmaco è stato generalmente ben tollerato e non sono emersi nuovi segnali di sicurezza nelle settimane dalla 16 alla 48.
«Con bimekizumab il miglioramento è abbastanza rapido e poi rallenta, ma continua per un lungo periodo di tempo» ha concluso. «Un comportamento molto coerente con la mia esperienza clinica con questo tipo di farmaci».
Referenze
Papp K et al. Izokibep, a novel IL-17A inhibitor, demonstrates HiSCR100 responses in moderate-to-severe hidradenitis suppurativa: Week 12 results of open-label part A of a phase IIb/III study. AAD 2023; Late-breaking research.
Forman S et al. Safety and efficacy of LY3041658, a novel septa-specific monoclonal antibody to CXCR1 and CXCR2 ligands, in a phase II study in hidradenitis suppurativa. AAD 2023; Late-breaking research.
Kimball AB et al. Bimekizumab in patients with moderate-to-severe hidradenitis suppurativa: 48-week efficacy and safety from BE HEARD I & II, two phase III, randomized, double-blind, placebo-controlled multicenter studies. AAD 2023; Late-breaking research.