Psoriasi: il trattamento con un inibitore orale sperimentale dell’interleuchina-17 a piccola molecola ha ridotto significativamente l’estensione e la gravità della malattia
Nei pazienti affetti da psoriasi, il trattamento con un inibitore orale sperimentale dell’interleuchina-17 a piccola molecola ha ridotto significativamente l’estensione e la gravità della malattia rispetto al placebo, secondo i risultati di uno studio di fase I comunicati dalla compagnia biotech DICE Therapeutics, che sta sviluppando il prodotto. All’annuncio dei dati le azioni della farmaceutica sono aumentate dell’89%.
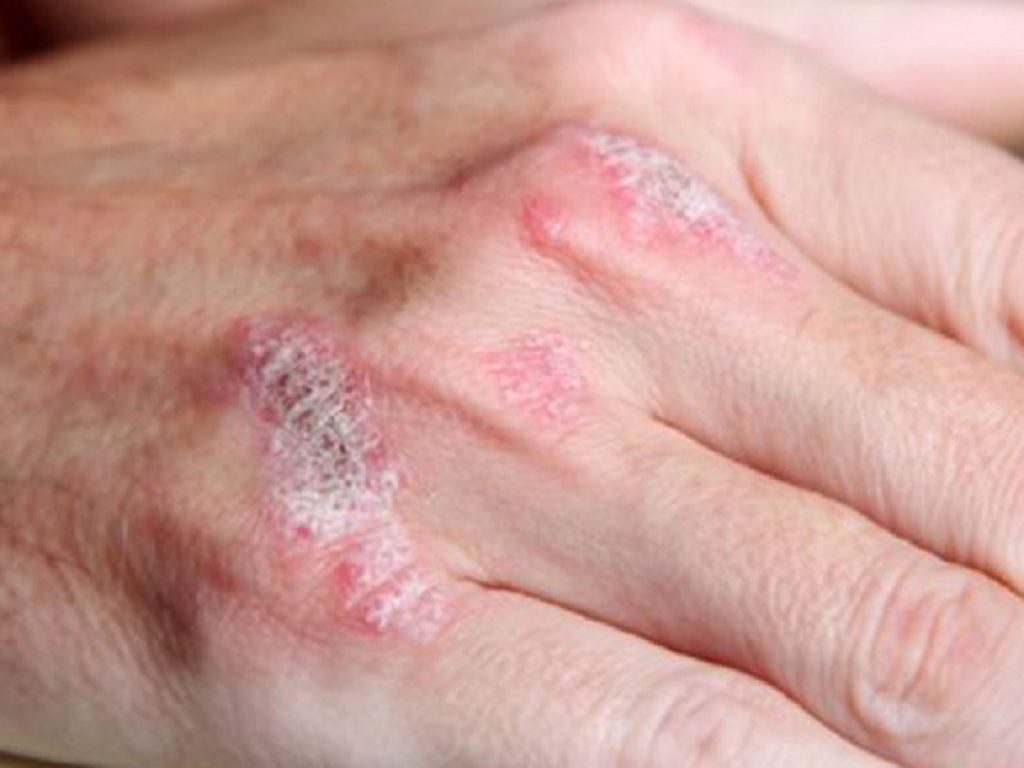
La psoriasi si manifesta come placche eritematose e desquamanti che possono verificarsi in qualsiasi parte del corpo. I sintomi includono prurito, sanguinamento e dolore, con effetti estetici deturpanti che comportano un notevole carico psicologico per i pazienti. Secondo la National Psoriasis Association, oltre 8 milioni di statunitensi e 125 milioni di persone in tutto il mondo hanno sofferto di psoriasi nel 2020.
Lo studio di fase I, il primo sull’uomo, randomizzato, in doppio cieco e controllato con placebo, è stato disegnato per generare dati di sicurezza e farmacocinetica in volontari sani di DC-806, questo per ora il nome dell’agente sperimentale, e per fornire un’evidenza clinica precoce in pazienti affetti da psoriasi. Prevedeva infatti tre parti sovrapposte: una fase 1a a dose singola ascendente (SAD) (n=40), una fase 1b a dose multipla ascendente (MAD) (n=32) e una fase 1c proof-of-concept in pazienti affetti da psoriasi (n=32) che ha arruolato un totale di 8 partecipanti nel gruppo ad alto dosaggio (800 mg BID), 13 nel gruppo a basso dosaggio (200 mg BID) e 11 nel gruppo placebo.
Riduzione significativa dell’estensione e della gravità della malattia
Dopo sole 4 settimane di trattamento, la riduzione percentuale media dello Psoriasis Area and Severity Index (PASI) rispetto al basale, un endpoint esplorativo, è stata del 43,7% nel gruppo ad alto dosaggio rispetto al 13,3% nel gruppo placebo, con un valore p esplorativo di 0,0008. Nel braccio a basso dosaggio la riduzione è stata del 15,1%.
La risposta clinica è stata mantenuta anche nei pazienti con un maggior carico di malattia, con i gruppi sottoposti alla dose più alta e più bassa con un punteggio PASI ≥6 al basale che hanno raggiunto una variazione dei punteggi rispettivamente del 47% e del 31,4% rispetto all’11% nel gruppo placebo.
Entrambe le dosi di DC-806 hanno dimostrato di essere biologicamente attive attraverso l’analisi dei biomarcatori, evidenziando un coinvolgimento dose-dipendente del target interleuchina (IL)-17, una rapida insorgenza dell’effetto ed effetti farmacodinamici coerenti con l’inibizione diretta della segnalazione della IL-17.
Il nuovo agente è stato ben tollerato con un eccellente profilo di sicurezza in tutti i gruppi di dosaggio, sia nei volontari sani che nei pazienti affetti da psoriasi a tutti i livelli di dose valutati, senza eventi avversi gravi, nessun evento avverso dose-limitante, nessuna interruzione della terapia correlata al trattamento e nessun cambiamento clinicamente significativo nei parametri clinici e di sicurezza di laboratorio (inclusi gli enzimi epatici).
Tutti gli eventi avversi emergenti dal trattamento (TEAE) sono stati classificati come lievi o moderati senza una tendenza dose-dipendente nella frequenza, gravità o tipologia osservati.
DC-806 ha mostrato un profilo farmacocinetico favorevole con aumenti proporzionali alla dose delle concentrazioni sieriche durante tutto lo studio. L’analisi dei dati MAD e della fase 1c ha mostrato il raggiungimento della copertura IC50 e IC90 con le dosi rispettivamente di 175 mg una volta al giorno e 400 mg due volte al giorno.
In sviluppo una serie di candidati orali contro la psoriasi
DICE sta sviluppando antagonisti a piccole molecole disponibili per via orale della molecola di segnalazione pro-infiammatoria IL-17, una citochina derivata da cellule immunitarie che viene prodotta in risposta all’infezione da alcuni microrganismi. Dopo essersi legata al suo recettore su vari tipi di cellule presenti nei tessuti (come cheratinociti, fibroblasti e cellule epiteliali), la IL-17 scatena una serie di segnali responsabili di un’infiammazione tissutale sostenuta, che ha l’obiettivo di eliminare l’agente patogeno.
Nelle malattie autoimmuni, il sistema immunitario sembra reagire in modo sproporzionato e scatenare forti risposte immunitarie in assenza di un evidente evento infettivo. La ricerca ha dimostrato che la IL-17 è un potente driver della psoriasi.
La compagnia prevede di presentare una nuova investigational new drug (IND) application alla Fda nella prima metà del 2023 e di far avanzare DC-806 in uno studio di fase IIb a dose variabile in pazienti con psoriasi da moderata a grave. Ha anche anticipato di seguire lo sviluppo di un ulteriore candidato chiamato DC-853, i cui dati di fase I sono previsti nella seconda metà del prossimo anno.