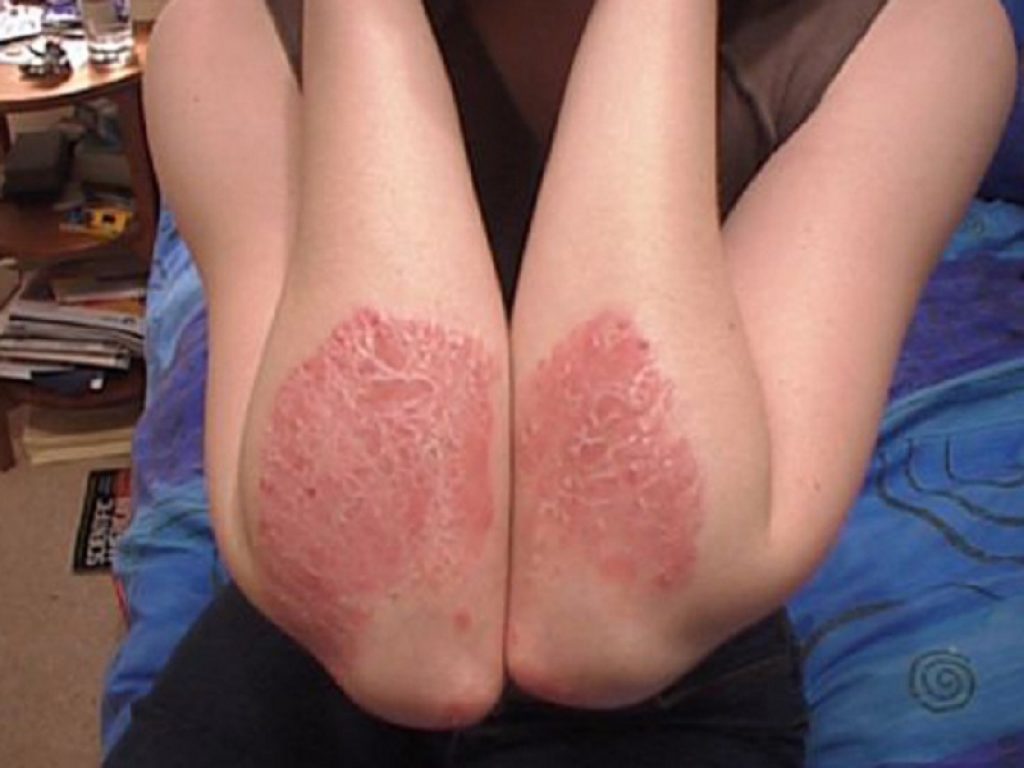
Psoriasi a placche: al Congresso dell’American Academy of Dermatology sono stati presentati 11 abstract relativi a bimekizumab
Presentati 11 abstract relativi a bimekizumab nel trattamento di pazienti adulti affetti da psoriasi a placche da moderata a severa.
Bimekizumab è un anticorpo monoclonale IgG1 umanizzato progettato per inibire selettivamente e direttamente le interleuchine 17A (IL-17A) e 17F (IL-17F), due citochine che svolgono un ruolo chiave nei processi infiammatori.
La presentazione ha fornito dettagli in merito a nuove analisi di dati aggregati provenienti da cinque studi clinici di fase 3/3b su bimekizumab, rivelando come oltre l’80% dei pazienti che avevano raggiunto una completa skin clearance (PASI100) alla settimana 16 e che avevano acconsentito a partecipare agli sudi di open-label extension (OLE) abbiano mantenuto la risposta lungo i 2 anni di follow up, senza che siano emersi nuove segnalazioni di farmacovigilanza.
Tra i poster presentati, nuovi dati dal periodo OLE dello studio di fase 3b BE RADIANT hanno mostrato che le risposte cliniche (PASI100 e PASI assoluto, PASI ≤2) raggiunte alla settimana 48 sono state mantenute fino alla settimana 96 con il trattamento continuativo con bimekizumab e sono migliorate per i pazienti che sono passati da secukinumab a bimekizumab all’ingresso nell’OLE.
I pazienti che erano PASI90 non-responder con secukinumab alla settimana 48 hanno ottenuto risposte cliniche migliori (PASI90 e PASI100) dopo il passaggio a bimekizumab nell’OLE3. Tra i pazienti che erano PASI90 responder con secukinumab alla settimana 48, la risposta PASI90 è stata mantenuta e la risposta PASI100 è aumentata dopo il passaggio a bimekizumab nell’OLE3. Nell’Unione Europea e in Gran Bretagna, bimekizumab è il primo inibitore selettivo di IL-17A e IL-17F ad essere approvato per il trattamento della psoriasi a placche da moderata a severa negli adulti candidati alla terapia sistemica. Bimekizumab è attualmente in fase di revisione da parte della Food and Drug Administration (FDA) statunitense per il trattamento della psoriasi a placche da moderata a severa negli adulti.
“Una skin clearance completa e a lungo termine è un obiettivo importante per le persone affette da psoriasi, e i nuovi dati a 96 settimane del periodo di estensione in aperto dello studio BE RADIANT offrono nuovi insight sul mantenimento della risposta e sul potenziale clinico di bimekizumab nella psoriasi a placche da moderata a severa”, afferma Bruce Strober, M.D., Ph.D., Clinical Professor, Department of Dermatology, Yale University School of Medicine, New Haven, CT, U.S., and Central Connecticut Dermatology Research, Cromwell, CT, U.S. “Inoltre, le migliori risposte cliniche viste nei pazienti che sono passati a bimekizumab dopo 48 settimane di trattamento con secukinumab offrono ulteriori nuove informazioni che dovrebbero contribuire allo sviluppo della futura pratica clinica.”
Studi di fase 3/3b: dati aggregati a due anni per bimekizumab in pazienti con psoriasi a placche da moderata a severa.
I dati sono stati raggruppati dagli studi di fase 3 BE VIVID, BE READY e BE SURE, dallo studio di fase 3b BE RADIANT e OLE (48 settimane), e dal primo anno dello studio BE BRIGHT OLE. L’analisi ha valutato il mantenimento del PASI100 per due anni (OLE 48 settimane) tra i PASI100 responder alla settimana 16 che sono entrati nei rispettivi studi OLE e hanno ricevuto un dosaggio di mantenimento continuo di bimekizumab dalla settimana 16 (320 mg ogni 4 settimane [Q4W/Q4W/Q4W] o Q4W/Q8W/Q8W*).
Alla settimana 16, il 62,4% dei pazienti trattati con bimekizumab (n=850) ha raggiunto PASI100. Di coloro che sono entrati negli OLE, l’85,1% (Q4W/Q4W/Q4W; n=316) e l’83,8% (Q4W/Q8W/Q8W*; n=267) hanno mantenuto PASI100 al secondo anno (settimana OLE 48). I tassi di incidenza corretti in funzione dell’esposizione (EAIRs) di eventi avversi complessivi e seri emergenti dal trattamento (TEAEs) sono stati pari a 192,7 e 5,9. I TEAE più comuni sono stati rinofaringite (EAIR di 18,4), candidosi orale (13,0) e infezioni del tratto respiratorio superiore (7,8). Quasi tutti i casi di candidosi orale (98,1%) sono stati lievi o moderati.
Studio BE RADIANT open-label extension in pazienti con psoriasi a placche da moderata a severa: dati di efficacia e sicurezza in un periodo di 96 settimane 2
I livelli di completa skin clearance (PASI100) osservati con bimekizumab nello studio BE RADIANT sono stati mantenuti nell’OLE fino alla settimana 96 (74,8% e 70,6% alle settimane 48 e 96, rispettivamente) e sono migliorati per i pazienti che sono passati da secukinumab a bimekizumab all’ingresso nel periodo OLE (52,8% e 76,1% alle settimane 48 e 96, rispettivamente). Anche la risposta PASI assoluta (PASI≤2) è stata mantenuta fino alla settimana 96 (94,3% e 93,4% alle settimane 48 e 96, rispettivamente) ed è migliorata per i pazienti che sono passati da secukinumab a bimekizumab all’inizio del periodo OLE (83,9% e 94,6% alle settimane 48 e 96, rispettivamente). Durante l’OLE, gli eventi avversi più comuni con bimekizumab sono stati nasofaringite (11.8/100 pazienti-anno), candidosi orale (7.8/100 pazienti-anno) e infezione del tratto urinario (4.5/100 pazienti-anno). Gli eventi avversi sono stati comparabili tra i pazienti che hanno proseguito il trattamento con bimekizumab o che sono passati dal trattamento con secukinumab a quello con bimekizumab. L’incidenza degli eventi avversi seri è stata bassa. Queste analisi hanno incluso 336 pazienti trattati con bimekizumab e 318 pazienti trattati con secukinumab che hanno completato il periodo in doppio cieco BE RADIANT e sono entrati nell’OLE
Studio BE RADIANT open-label extension in pazienti con psoriasi a placche da moderata a severa: analisi dei responder nei pazienti che passano da secukinumab a bimekizumab
53/318 pazienti (16,7%) trattati con secukinumab non avevano raggiunto il PASI90. Dopo il passaggio a bimekizumab nell’OLE, le risposte sono migliorate. Alla settimana 96, il 79,2% di questo gruppo ha raggiunto il PASI90 e il 50,9% il PASI100. Alla settimana 48, 256/318 pazienti (80,5%) trattati con secukinumab avevano raggiunto il PASI90. Dopo il passaggio a bimekizumab nell’OLE, il 95,2% di questo gruppo ha mantenuto questa risposta alla settimana 96 e la risposta PASI100 è aumentata dal 65,2% alla settimana 48 al 79,9% alla settimana 96. Nessuna differenza clinicamente rilevante nei risultati di sicurezza per i pazienti che sono passati da secukinumab a bimekizumab è stata osservata dalle settimane 48-96
In merito agli studi BE READY, BE VIVID e BE SURE e allo studio BE BRIGHT open-label extension
L’efficacia e la sicurezza di bimekizumab nel trattamento di adulti con psoriasi a placche da moderata a severa sono state valutate in tre studi di Fase 3, verso placebo e ustekinumab (BE VIVID), verso placebo (BE READY) e verso adalimumab (BE SURE). I pazienti che hanno completato uno di questi tre studi di Fase 3 sono stati eleggibili per iscriversi allo studio open-label extension BE BRIGHT.
In merito agli studi BE RADIANT e BE RADIANT open-label extension
BE RADIANT è uno studio di fase 3b, randomizzato, multicentrico, in doppio cieco, controllato con comparatore attivo, a gruppi paralleli, progettato per valutare l’efficacia e la sicurezza di bimekizumab rispetto a secukinumab in adulti con psoriasi a placche cronica da moderata a severa. I pazienti che hanno completato il periodo in doppio cieco di 48 settimane hanno potuto iscriversi alla open-label extension di 96 settimane, dove tutti hanno ricevuto bimekizumab.